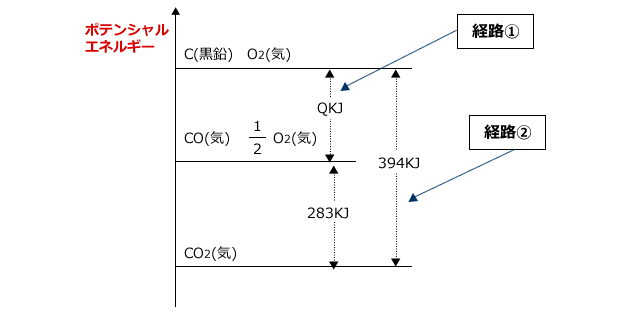
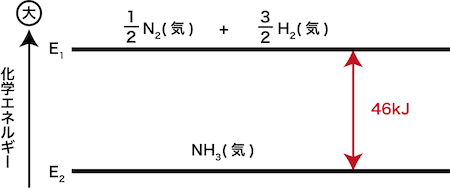
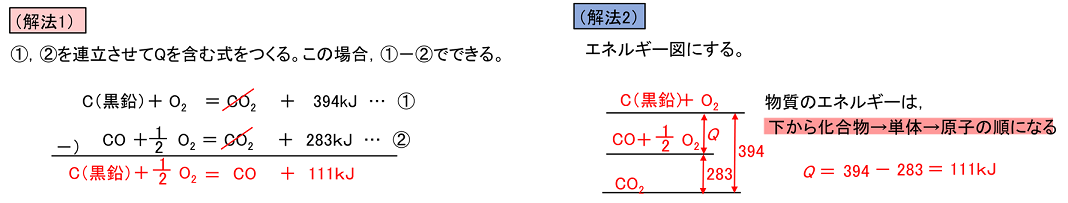
(1) 水の蒸発熱は,1gあたり何kJか。 (2) メタノール(液)の生成熱は何kJ/molか。 (1) 熱化学方程式は,H2O (液) = H2O (気) + QkJ。 ①-②より,Q=286-242=44〔kJ/mol〕。 この値はH2O 1mol(=18g)あたりの値なので10gでは,44×(10/18)=244≒24〔kJ〕 (2) 熱化学方程式は,C (黒鉛) + 2H2 + 1/2O2 = CH3OH (液) + QkJ。 2①+③-④より,Q=572+394-726=240化学反応とエネルギー 反応のエネルギー図 化学反応とエネルギー 化学反応にはエネルギーの出入りが伴う。 発熱反応:反応に伴って、エネルギーが放出される。 吸熱反応:反応に伴って、エネルギーが吸収される。 → この「エネルギー」の正体は何? 物質が持つエネルギー 力学的エネルギ水性ガスシフト反応は、 有毒ガスである一酸化炭素に水を吹き込んで、 燃料である水素を生成する(文献6)。 水素は、 燃焼によって水だけを生 成する最もクリーンな燃料であるため、水性ガスシフト反応は、 燃料技術における最も重要な反応である。 ギ酸の2つの分解経路の競合の平衡は、水性ガスシフ ト反応の平衡によって決まる。 ギ酸の分解平衡の解析に
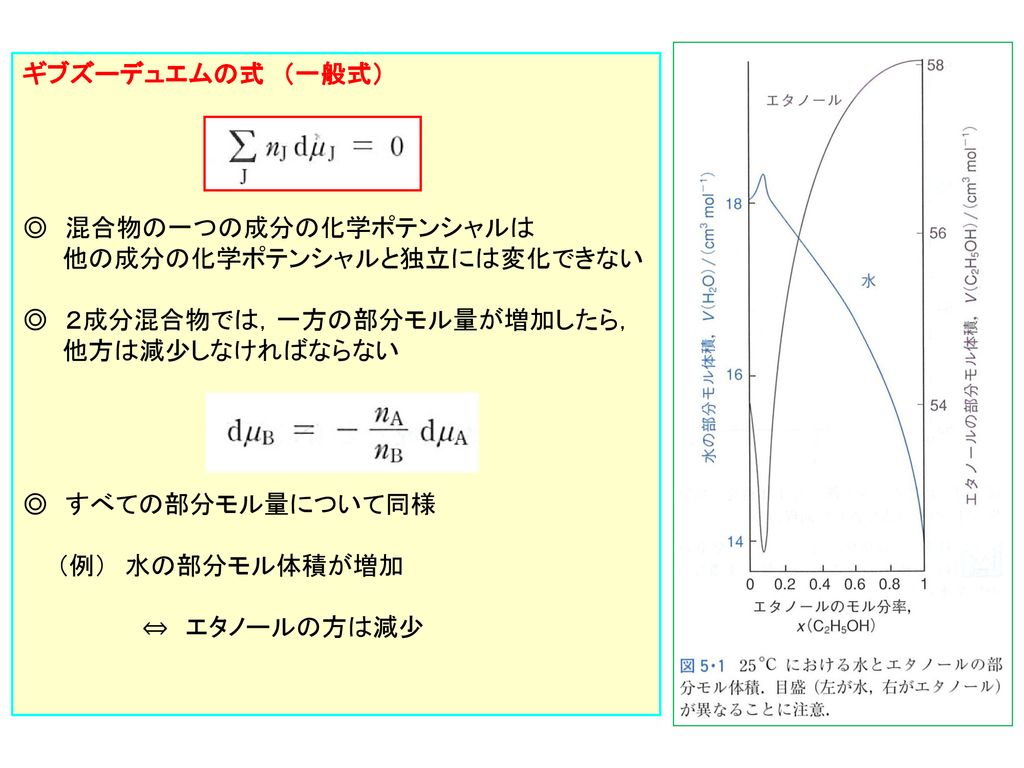
D ギブズ デュエムの式 2成分混合物の全ギブスエネルギー 化学ポテンシャルは組成に依存 Ppt Download
水 エネルギー 化学
水 エネルギー 化学-H h=2ˇ を用い En = jE1j n2;JE1j (1 4ˇ"0)2 (me4 2 h2) (1) と表される。次の問いに答えよ。




身近な材料で エネルギー を創り出そう みらいぶプラス 河合塾
物理化学でのエネルギー エネルギー の その滝であるが、実は「滝から落ちる前の上の水と流れ落ちた下の水の水温は微妙に違う」ということが考えられる。理論的には滝から落ちた後の水のほうが、水温が少しだけ上昇しているはずである。 1gの水が50m上から落ちるとする。このときの水の場合、 運動の自由度は 並進 3, 回転 3, 振動 3 となります。振動エネルギーのエネルギーギャップは 1595 cm −1, 3657 cm −1, 3756 cm −1, で、やはり赤外線のエネルギーに相当します。 一方、電子レンジで使われている電磁波はマイクロ波(振動数 245 GHz) で、 どちらの方法でも、鍵になってくるのが下記の化学式です。 2H 2 O 2 –> 2H 2 O 熱・電気エネルギー 化学式が難しいと感じるかもしれませんね。
水素の特性 水素は地球上で最も軽い、無色無臭の気体です。 宇宙にもっとも多く存在する基本元素で、地球上では水や炭化水素等の化合物の状態で存在します。 ガソリン1L(約750g)と同じエネルギーを得るために必要な水素は1m 3 (約90g)です。 水素はとおいて、化学ポテンシャルと呼ぶ。 数式で書いたが、化学ポテンシャルの定義は、モルあたりの自由エネルギーで あると考えればよい。すなわち、dn モルの水が持っている自由エネルギーは1 モルあたりの自由エネルギーがi とすると、idni となる。 化学結合が再形成されて水が生成されると、追加のエネルギーが放出され、反応が伝播します。 正味の反応は非常に発熱性であり、熱の放出を伴う反応を意味します。 2つのデモンストレーション 一般的な化学のデモンストレーションの1つは、小さなバルーンに水素と酸素を充填し、離
なぜ100℃になった途端蒸発し気体になるのか。 答えは「温度を上げるほど水分子の運動が激しくなり、0℃ (or100℃)になった途端に固体 (or液体)の形を保てなくなる」からだ。 実は上記の概念をエンタルピーやエントロピーなどといった熱力学視点でまとめたのがギブスの自由エネルギーなんだ。 今回は理系ライターのR175とみていこう。 2.水素はそもそもエネルギー源ではない 結論から言います。 水素はそもそもエネルギー源ではありません。 だから「水素は海水か取り出せば無尽蔵のエネルギー源になる」というのはウソです。 なぜなら水から水素を作り出すために消費されるエネルギーは、できた水素から得られるエネルギーよりも必ず大きくなるからです。 例えば、使ったお金より4000℃以上の高温では熱エネルギーのみで水分解が生じ る(水の直接熱分解)。 熱化学水素製造法は,複数の反応を組み合わせること で,直接熱分解温度より低温の熱で水を分解するために 必要な仕事を生み出す。仮想物質aを用いた反応構成 の例を以下に示す。




光合成プロセスランディングページテンプレートセット インフォグラフィックの小さな科学者のキャラクターは 太陽光を化学エネルギーに変え 水を酸素に分解します 漫画の人々のベクトル図 プレミアムベクター




ビッグジョン Sustainable Jeans サステイナブル ジーンズ を開発 化学薬品ゼロ 水削減 エネルギー削減へ ビッグジョン のプレスリリース
こんにちは! 行列、ヤコビアンとやってきまして、ひと通り準備は完了しましたので、今回から量子化学の話に戻っていきたいと思います。 今回のテーマはこちら! 変分法を使って水素原子の基底状態のエネルギーを計算してみよう! 動画はこちら↓ 大学の物理化学 変分法 水素原子の基底状態 動画で使ったシートはこちら ( hydrogen calculus of variations) で 熱化学を0から学ぶシリーズ第3回 ~エネルギー図の基本・書き方と5つの原則~ さて、前回「熱化学シリーズ第2回:熱化学方程式と化学反応式」では"熱化学方程式"を学びました。 今回は、熱化学の中でも最重要、かつ最も苦手とする人が多い「エネルギー図」を紹介します。エネルギー物質 (水) (水素 酸素) (メチルシクロヘキサン 酸素) (トルエン 水) (水) (水素 酸素) 膜型電気化学セルの基本構成 (水電解・燃料電池) 非貴金属高機能電極触媒が鍵 高効率に化学エネルギーと電力を直接変換 再エネ電力を貯める・運ぶ・使う /再エネ電力でモノづくりが鍵 h
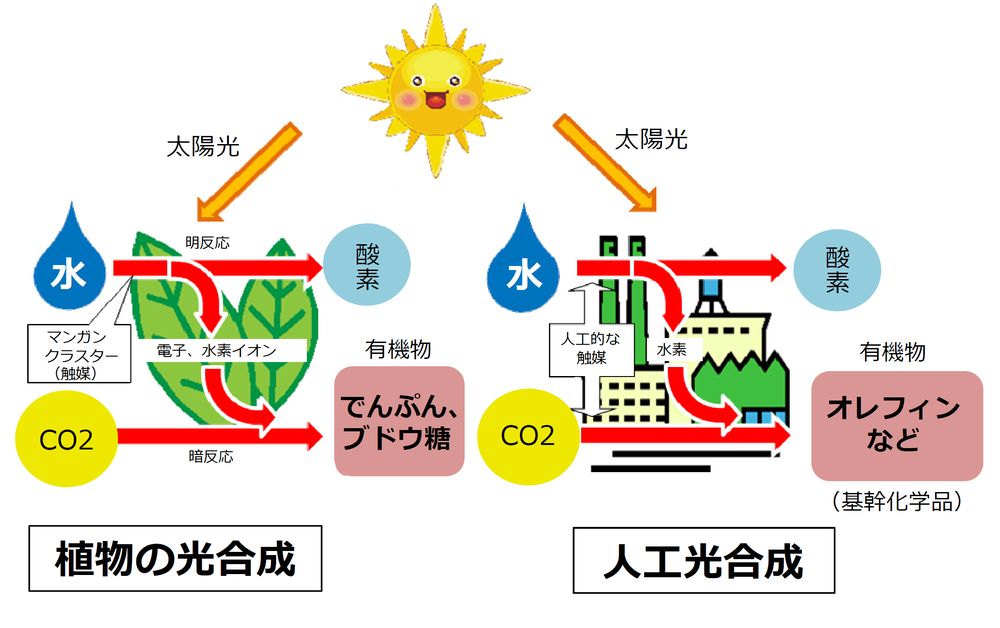



太陽とco2で化学品をつくる 人工光合成 今どこまで進んでる スペシャルコンテンツ 資源エネルギー庁




身近な材料で エネルギー を創り出そう みらいぶプラス 河合塾
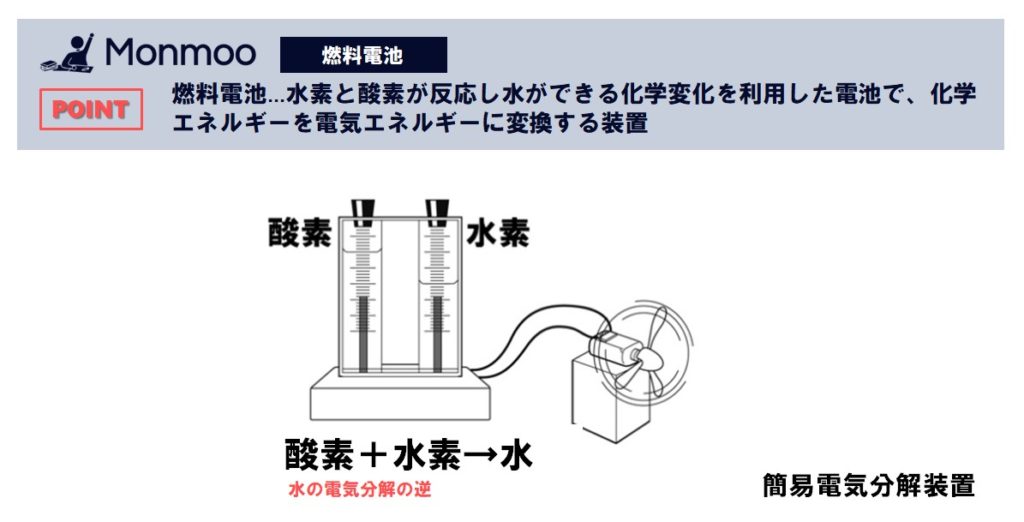
その性質により、水素原子は近くに他の水素原子があると結合しようとします。 不安定な状態である原子同士が結合すると、電子を束縛する力は原子の時より強くなり、束縛から逃れようとする動き(エネルギー)を失います。 この結合する際の原子の動きが周囲の物質を振動させることで、熱エネルギーとして放出されるのです。 以上、化学エネルギー化学結合に伴うエネルギー より強い結合が作られると、より多くの熱が放出されます。 結合の生成によって生じる熱エネルギーは結合によって決まっています。(ヘスの法則) 高校ではこれは熱化学方程式として書かれていましたが、大学では 仕事 なども含めて扱うために、反応に伴う系の 水素と酸素を反応させると、水が生じました。空気中で水素に火をつけたときと同じ反応です。このときに電気エネルギーが取り出せるのです。 燃料電池 水素 + 酸素 → 水 + 電気エネ




ビッグジョン Sustainable Jeans サステイナブル ジーンズ を開発 化学薬品ゼロ 水削減 エネルギー削減へ ビッグジョン のプレスリリース
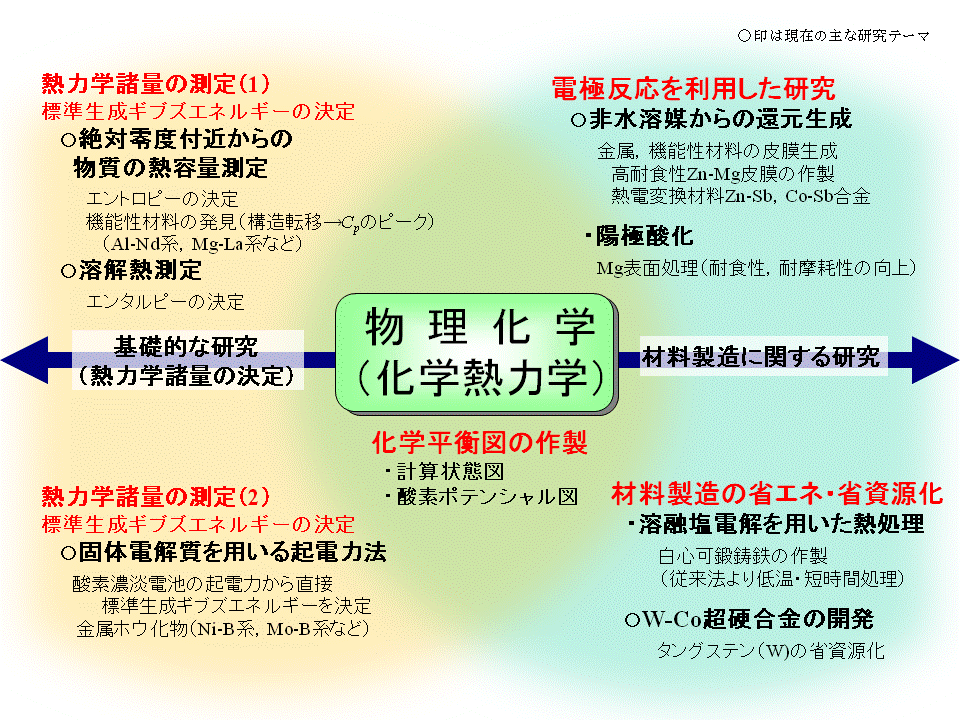



熱化学研究グループ 研究分野 研究テーマ
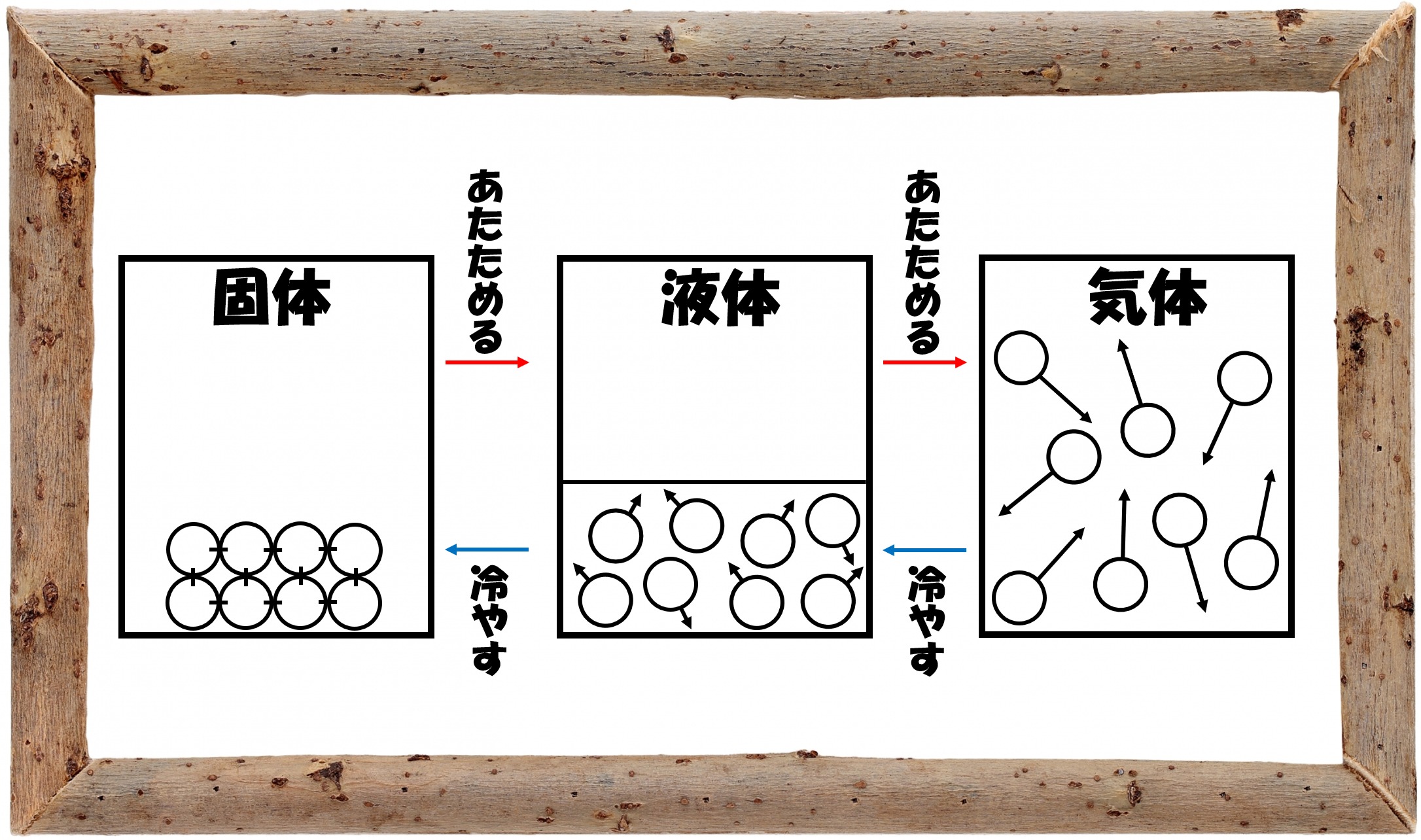
複数ある物質が同化して1つになり、同じ機能、性質へ変わることに必要な力を、私たちは生体エネルギーと呼んでいる。 これは、どんな物でもこの力を持っており、様々な環境においてこの生体エネルギーが作用している。 水を例にみてみる。 水は、水素原子2つと酸素原子1つで出来ている。 この水分子の水素と酸素はまったく違う他の物質になったわけでは化学の基礎固め 物質の最も小さなツブを「分子」と呼びますが、熱エネルギーによって「水の分子」はどのように変化していくのでしょうか。 今後のテーマである「ろうそくの燃焼」や「化学計算」などを学習するうえで、「化学の基礎固め」となりますので、 覚えるというよりもイメージエントロピーSの次元はJK1 ギブスエネルギー:ΔG° = ΔH° TΔS° 反応はΔG°が減る向きに進む 例の場合は,気体15mol( mL)が水1mol(18mL)になるの で,ΔS° < 0,ΔG°=kJ ΔG°が,化学変化で利用できるエネルギー である(これが,物質本来のエネルギーである。 宣伝に出てくる 「水本来のエネルギー」などという言い方は変で,物質として水で ある限り,ΔG°を指標
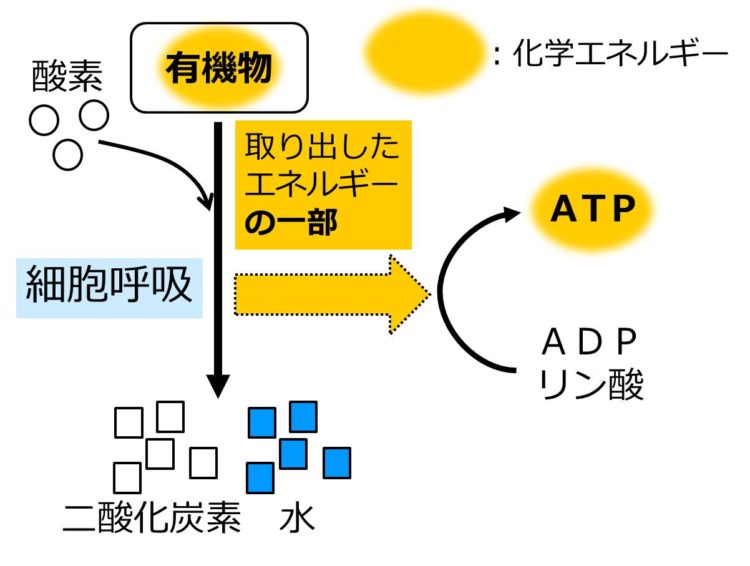



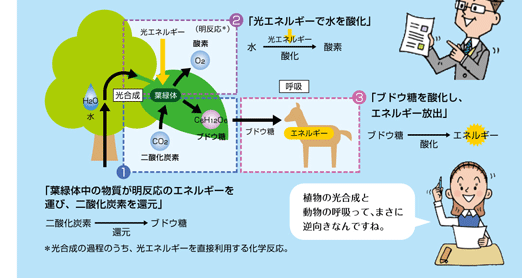
細胞呼吸 呼吸 と光合成 せいぶつ農国
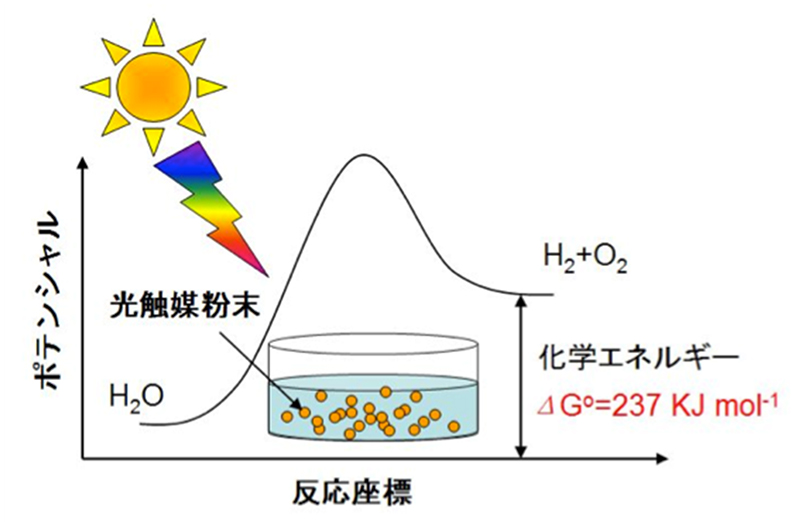



研究内容 工藤研究室 光触媒研究グループ 東京理科大学理学部第一部 応用化学科
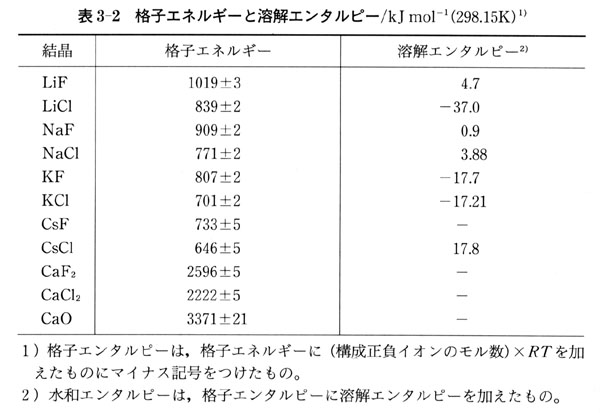
水の話 ~化学の鉄人小林映章が「水」を斬る!~ 4章 水の係わる反応 小林 映章 (4)水和エネルギー 原子、分子やイオンが幾つかの水分子と相互作用を起こして水和の状態になるときに発生するエネルギーを水和エネルギー(hydration energy)と呼びます。 一般に水和物を形成する際には水素と酸素から水が生成する反応の熱化学方程式は,化学便覧( 25 ℃ 1 気圧)に 2H 2 ( g ) + O 2 ( g ) → 2H 2 O ( l ) Δ f H 0 = -285 kJ /mol Δ f H 0 :反応熱(標準生成エンタルピー変化) と記述されている。 この反応式を用いて,化学便覧から得られる結合解離エネルギー( 0 ℃ 1 気圧)などのエネルギー化学 Web Class syllabus 539 📆 水 🕥1030 🕛10 ( 暦 ) 仮想教室中示範B C1 zero zoom 前回 前回は 電池の起電力―銀塩化銀電極とネルンストの式―を勉強しました。 水を水素と酸素に熱分解しようとしたら、2500度もの高温が必要だ。 電気を使えば、室温で乾電池をふたつ直列につなぐ
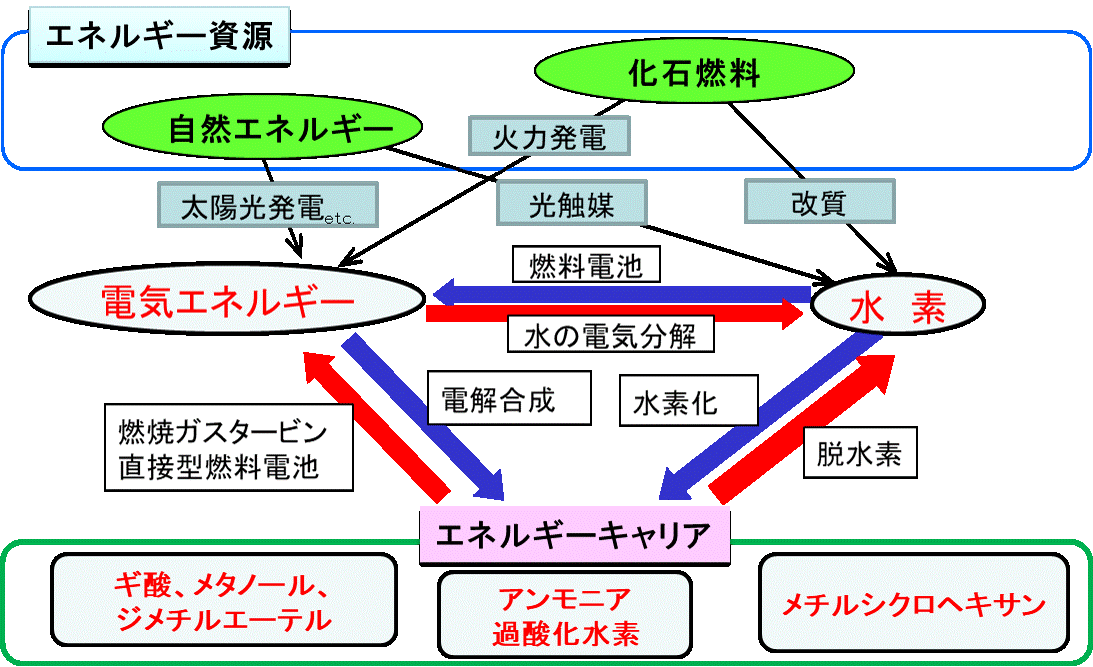



徳島大学 理工学部理工学科応用化学システムコース C3講座




ミニ講義 水分解 で環境 エネルギー問題に挑戦する Utokyo Tv
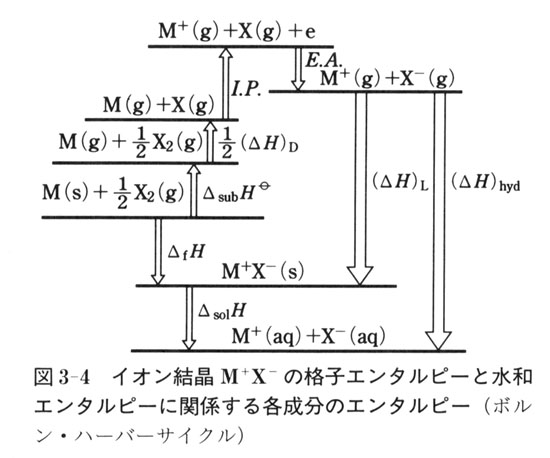
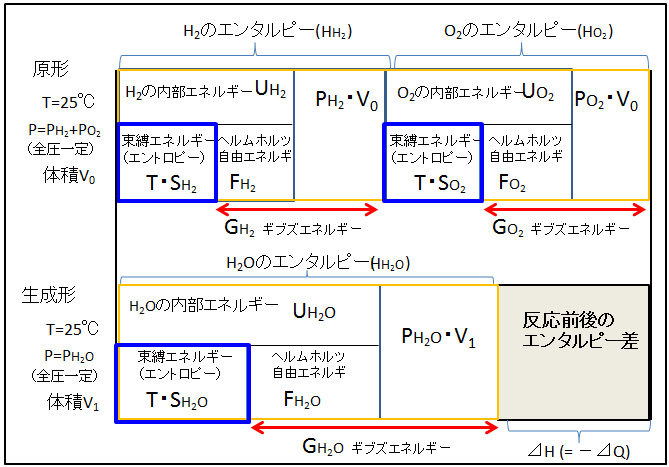
水和エネルギー スイワエネルギ hydration energy 一般に,ある化学種が 水和 するとき放出されるエネルギーをいう. Ⅰ 希薄な 気体 粒子 (とくに正・ 負イオン ,電子)が水に溶解して水和物になるとき放出されるエネルギー.塩 MX が直接水に溶解して M aq+ と X aq- となるときの吸熱量を q ,一方,塩MXが 格子エネルギー U を吸収して,いったん M + と X - の気体イオンとなり,ついで原形の水素と酸素が反応すると、水 (H2O) が生成されます。 ・生成形の合計エンタルピー: HH2O ・合計ギブズエネルギー: GH2O です。 ・生成形と原形のギブズエネルギーの差(⊿ G生成形-原形 ): GH2O -( GH2 + GO2 ) ・生成形と原形の束縛エネルギー差( T ⊿ S生成形-原形 ): T ・ SH2O -( T ・ SH2 + T ・ SO2 ) ・生成形と原形のエンタルピー差(⊿ H生成 水の中で安定化した電子のエネルギーを決定 鈴木俊法 理学研究科教授、山本遙一 同博士課程学生、Ruth Signorell スイス連邦工科大学教授、David Luckhaus 同博士らの共同研究グループは、水中に捕らえられた電子(水和電子)の最安定状態のエネルギーを決定




住友化学は ターコイズ 旭化成や東レなども挑む水素製造技術開発の現在地 ニュースイッチ By 日刊工業新聞社
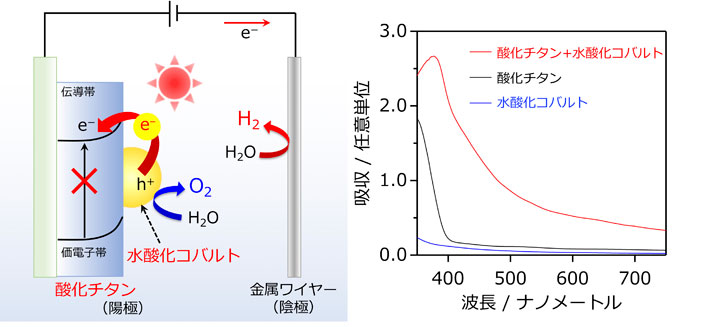



新しい原理で駆動する可視光水分解電極を開発 ありふれた物質に眠る有用な新機能を発見 東工大ニュース 東京工業大学
水素が燃えて発生する熱 別々に存在する状態に比べ、水分子となった状態のほうがエネルギー的に有利であるからです。 水素1モルと酸素05モルから水1モルが生成する時に発生するエネルギー(燃焼熱)は284 kJ です。 しかし実際には,水素を空気中に放置しておいても、自然に発火して燃焼するということはありません。 水素に火をつけるためには、点火源や水素化合物(すいそかごうぶつ、ハイドライド、英 Hydride )とは、水素と化合した物質のことである。 特に、狭義には水素と他の元素とから構成される二元化合物が水素化物と呼ばれる。 また、二元化合物以外の水素化合物も含めて水素化物と呼ぶ場合も多い。 今回のテーマはこちら! 水素分子のエネルギーを考えるもう1つの方法である、分子軌道法 (MO法)について考えていこう! 既にやった原子価結合法に関してはこちらの記事をご覧ください。 大学の物理化学水素分子の波動関数とエネルギーの求め方、原子価結合法 (VB法)を分かりやすく解説! 現実世界において水素はなぜ原子ではなく分子として存在



3 物質の化学結合エネルギー
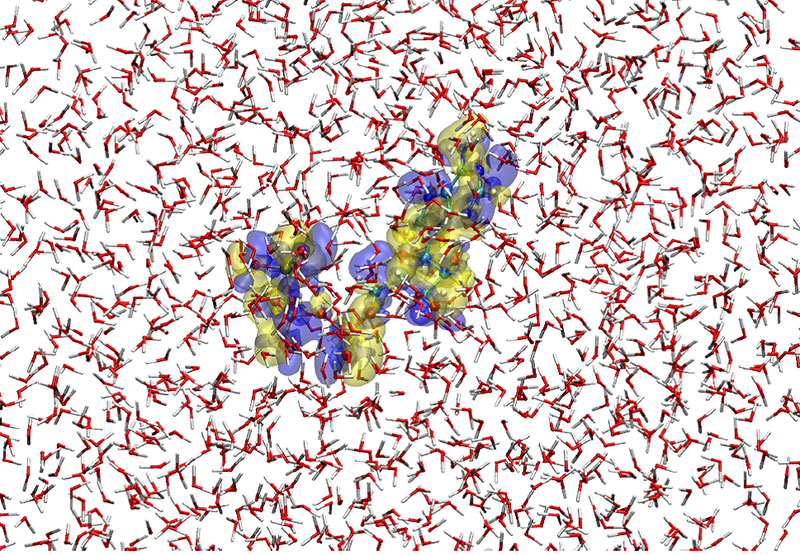



生命のatpエネルギーついに解明 超並列計算が水の働きを明示 ニュース 東北大学 工学研究科 工学部
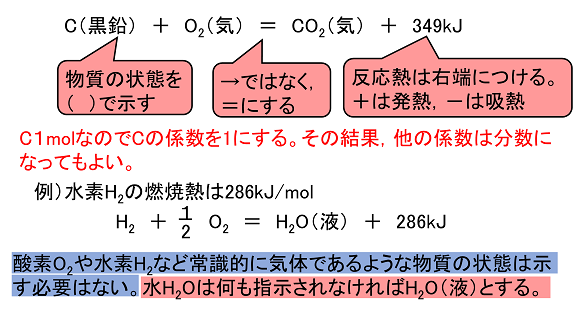
次の記述の内容を,熱化学方程式で表せ。なお,水が生じる場合は液体とする。 ⑴ メタンの燃焼熱は1 kJ/molである。 ⑵ 塩化カリウムの溶解熱は-17 kJ/molである。 ⑶ 二酸化炭素の生成熱は394 kJ/molである。 ( 5 ) 2編1章_化学反応と熱・光_生徒用 D 熱量 物質1 g の温度を1 K水素原子のイオン化エネルギーエネルギーhydrogenionizationenergyqa 水素原子(の主量子数nの電子状態の)エネルギーEn は電子の質量m 、電荷 e、真空の 誘電率"0,プランク定数h;量子化学の立場からは水分子が近寄って来て相 互作用するということは分子が充分離れていたと きとエネルギーが変化することを意味する。 そこ で2分 子間の相互作用エネルギーを量子化学計算 で得るには次のタイプの計算をすれば良いことに なる。 ステップ11分 子の量子化学計算を行いその 電子的エネルギーを求める。 これをE1と 置く。 ステップ22分 子を,相 互作用を知りたい分 子配置X1,X2




中国で開催された 楡林国際石炭 ハイエンドエネルギー化工産業博覧会 にて弊社社長が講演を行いました 環境に配慮した石炭化学産業基地構築のために ハイケム株式会社




身近な材料で エネルギー を創り出そう みらいぶプラス 河合塾
あなたが知っていること:水の気化熱= 2257 J / g = 540 cal / g 注:エンタルピーまたは熱の値を知っている必要はありません。 それらは問題で与えられるか、テーブルで調べることができます。 の解き方 この問題は、熱のジュールまたはカロリーを使用して解決できます。 パートI: 式Q = M・ΔHを使用 V Q IN =熱エネルギー、M =質量、及びΔHの V =気化熱を。 q =(25 しかし当たり前ですが、クリーンエネルギーと言っているのに石油から作っていては何の意味もないわけです。 なので、化石燃料に頼らない水素の発電が必要ですが、これは水の電気分解で行われます。 化学式 2H2O → 2H2 O2 水から水素を発生させると
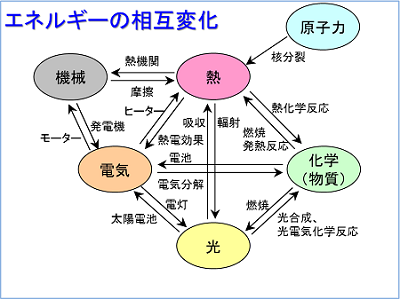



身近な材料で エネルギー を創り出そう みらいぶプラス 河合塾
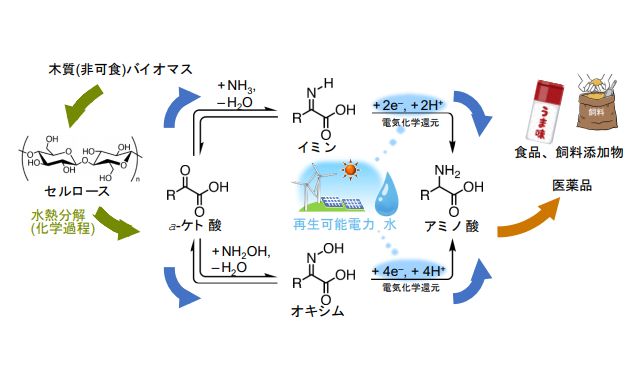



低環境負荷で高効率なアミノ酸合成法を開発 再生可能エネルギーから調達した電気と水 木質バイオマスから抽出した有機酸を使用 九州大学 Fabcross For エンジニア




高校化学 蒸発熱と昇華熱 映像授業のtry It トライイット




熱化学で扱う6種類の熱と3つのエネルギーをまとめて学習



化学エネルギー 例
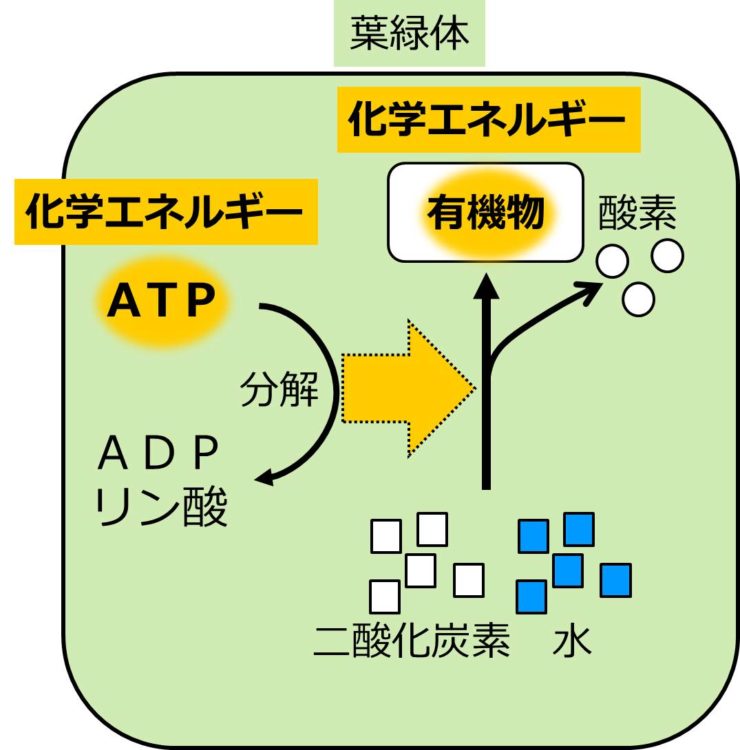



細胞呼吸 呼吸 と光合成 せいぶつ農国




光島 重徳 早稲田大学pep育成プログラム 文部科学省 卓越大学院プログラム



受験化学 24 エネルギー図 みかみの参考書ブログ




自宅で発電し 排出するのは水だけ 燃料電池とは 住まいの本当と今を伝える情報サイト Lifull Home 039 S Press




産総研 京大 エネルギー化学材料オープンイノベーションラボラトリ



3
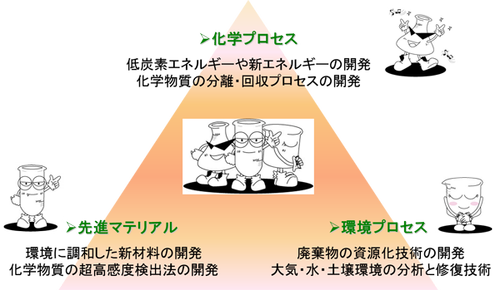



エネルギー循環化学科 北九州市立大学ひびきのキャンパス
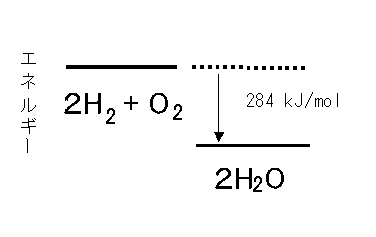



水素の燃焼
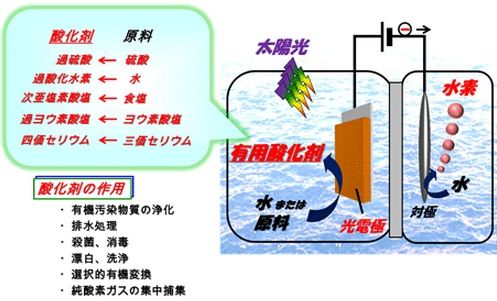



太陽光で水素を製造する新技術 少ないエネルギーで化学薬品も同時に作る 自然エネルギー スマートジャパン



Note
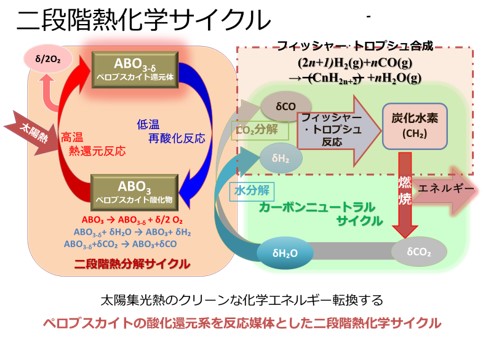



高温太陽集熱による二酸化炭素循環利用技術の開発 新潟大学 地域創生推進機構



第34章 生成熱と結合エネルギー



反応熱について 中学 高校の問題演習ができるホームページ
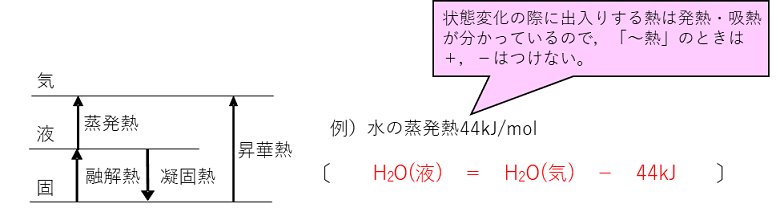



化学変化とエネルギー



エネルギー図の書き方 熱化学方程式を得意科目に 受験メモ
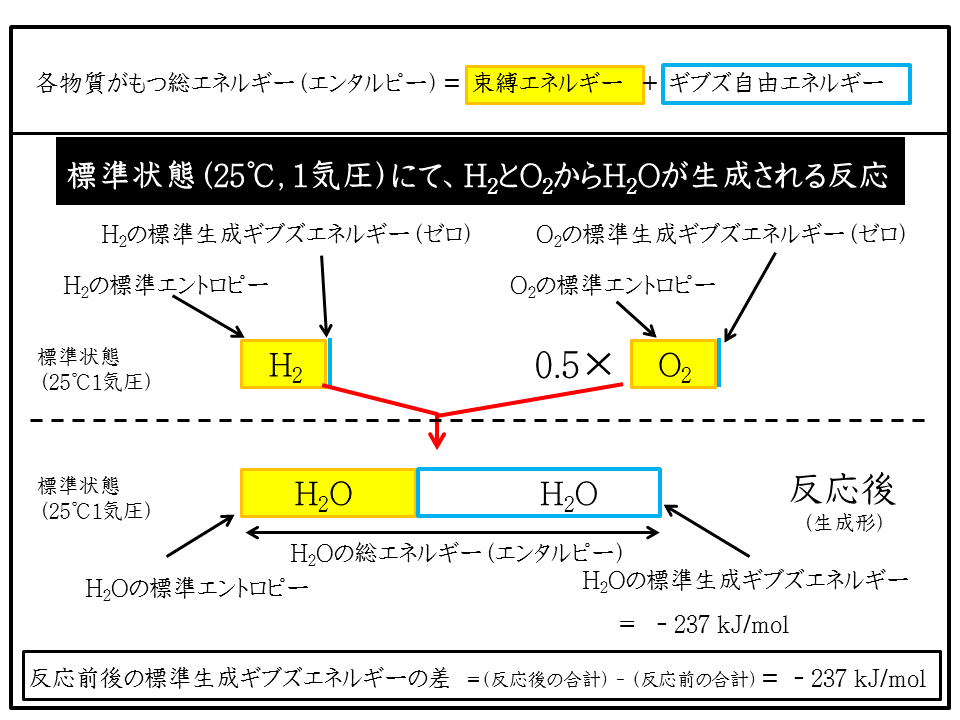



Course 物質が持つエネルギーの内訳 はじめに




呼吸鎖 酸素から水が生成する反応 起電力とギブズエネルギー 106回




プロトンってなに Npo法人プロトン医学研究所




D ギブズ デュエムの式 2成分混合物の全ギブスエネルギー 化学ポテンシャルは組成に依存 Ppt Download




エネルギー図の超体系的書き方とは ヘスの法則で熱化学方程式を図解せよ 化学受験テクニック塾



2 熱化学
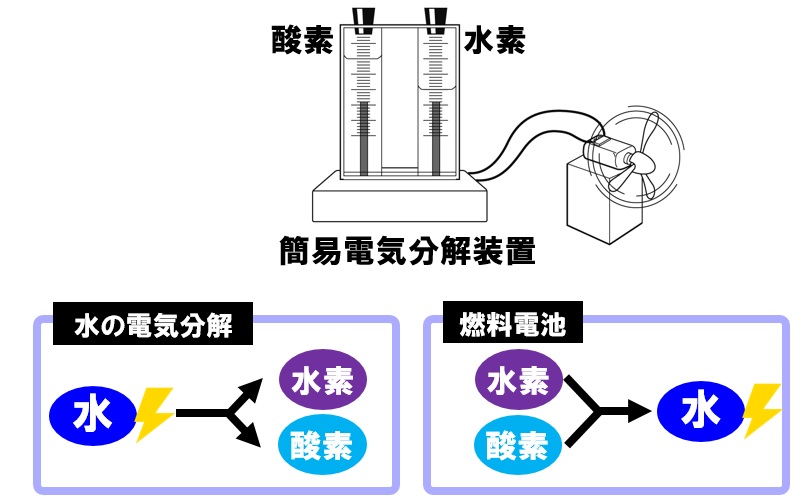



中3理科 燃料電池のポイント Examee




常温核融合エネルギー生産についてのベクトル図ですデュワー フラスコ真空カソードアノード重い水電解質方式科学と化学の図 ベクター画像のベクターアート素材や画像を多数ご用意 Istock



科学オリンピックだより 10 Vol 5 問2 解法と解答




水素結合とは 水などの例 沸点 エネルギー 距離と強さの比較 理系ラボ




反応熱の計算 生成熱 燃焼熱 溶解熱 中和熱 結合エネルギー 理系ラボ
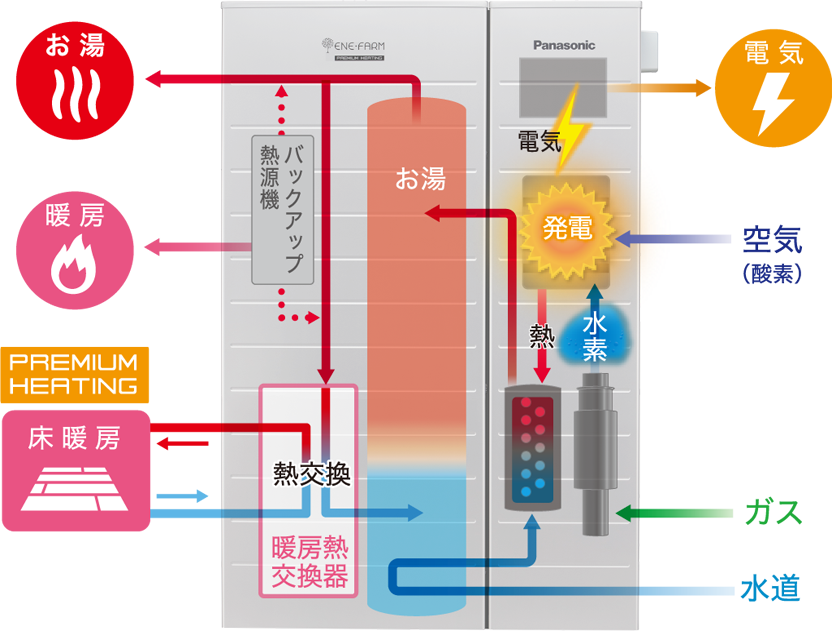



燃料電池とは エネファームとは 家庭用燃料電池 エネファーム Panasonic




中学3年理科 化学変化とその利用 化学変化とエネルギー 練習問題5 解答 あんのん塾
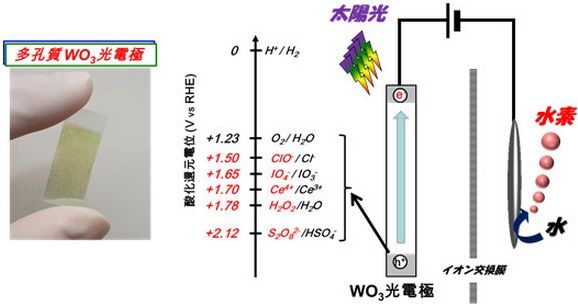



太陽光で水素を製造する新技術 少ないエネルギーで化学薬品も同時に作る 自然エネルギー スマートジャパン




ライブ配信セミナー 炭素循環 カーボンリサイクル 技術 3月23日 水 開催 主催 株 シーエムシー リサーチ Cmcリサーチのプレスリリース




水と空気からアンモニア 100年続く製法超えられるか 朝日新聞デジタル




東工大 将来のエネルギー問題を考えるサイエンス カフェを3 15に開催 リセマム




ミニ講義 水分解 で環境 エネルギー問題に挑戦する Utokyo Tv




写真のところが分かりません 誰か教えてください よろしくお願いします Clearnote



熱収支とエネルギー収支



化学講座 第33回 熱化学方程式 熱化学方程式の解き方 私立 国公立大学医学部に入ろう ドットコム




高校化学 ヘスの法則 練習編 映像授業のtry It トライイット



一覧 反応熱 燃焼熱 融解熱 解離エネルギーなど 総まとめ 化学のグルメ



中学受験の理科 化学の基礎固め 熱エネルギーと水の状態変化との関係 中学受験 理科 偏差値アップの勉強法



電気エネルギーを使った有機酸と水からの高効率なアミノ酸合成に成功 再生可能電力を用いた低環境負荷型の化学合成プロセスとして注目 研究成果 九州大学 Kyushu University




エネルギー関連化学 最新の研究




持続可能性 Boundary Supply Japan




Jeti Vol 66 No 2 1 エネルギー 化学 プラントの総合誌 特集 セルロースナノファイバー 炭素繊維 炭素材料 洗浄技術 日本出版制作センター 本 通販 Amazon



ギブズの自由エネルギー 化学ポテンシャル とは何か




結合エネルギーの問題です 解答解説の 式で 生成物の結合エネルギーの総和 Clearnote



コース 物質が持つエネルギーの内訳 化学反応前後の変化



中3理科 燃料電池のポイントまとめ ダイスト




身近な材料で エネルギー を創り出そう みらいぶプラス 河合塾




ライブ配信セミナー 水熱 超臨界水技術による資源変換 高付加価値化 循環利用 11月26日 金 開催 主催 株 シーエムシー リサーチ Cmcリサーチのプレスリリース



燃料電池 21世紀は 電池の姿が変わる 創考喜楽 教育業界の常識にquestionを投げかけるメディア



横浜国立大学エネルギー変換化学研究室




結合エネルギーの求め方と一覧表 理系ラボ



化学変化とエネルギー



化学変化とエネルギー



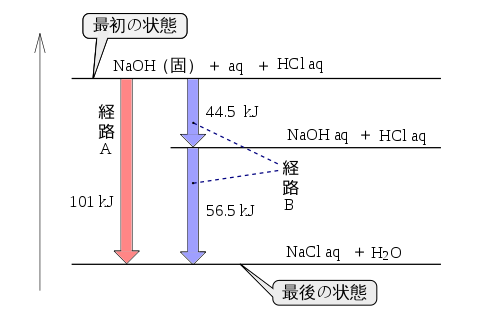
3



熱化学方程式はエネルギー図で考えろ 受験メモ




高校化学 熱量の計算 映像授業のtry It トライイット



高等学校化学i 化学反応と熱 Wikibooks




プロトンってなに Npo法人プロトン医学研究所



エネルギー図の書き方 熱化学方程式を得意科目に 受験メモ




燃料電池とは エネファームとは 家庭用燃料電池 エネファーム Panasonic




結合エネルギーの求め方と一覧表 理系ラボ




光合成とは 化学反応の詳細や酵素 人工光合成について詳しく解説 地球の未来を宇宙から考えるメディア Beyond Our Planet
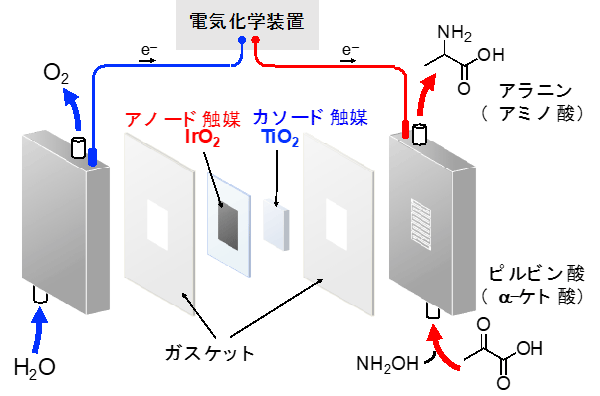



電気エネルギーを使った有機酸と水からの高効率なアミノ酸合成に成功 テック アイ技術情報研究所




29 熱化学 エネルギー図 演習 Youtube




ライブ配信セミナー 水熱 超臨界水技術による資源変換 高付加価値化 循環利用 1月25日 火 開催 主催 株 シーエムシー リサーチ Cmcリサーチのプレスリリース
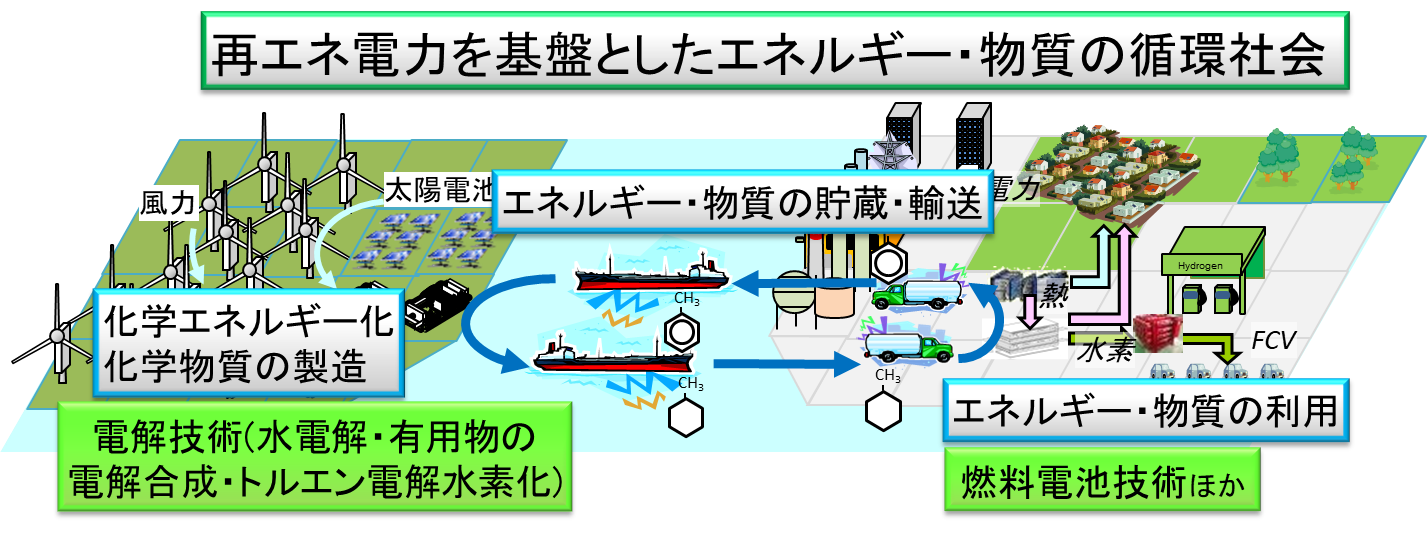



グリーン水素研究ラボ 先進化学エネルギー研究センター 横浜国立大学 先端科学高等研究院
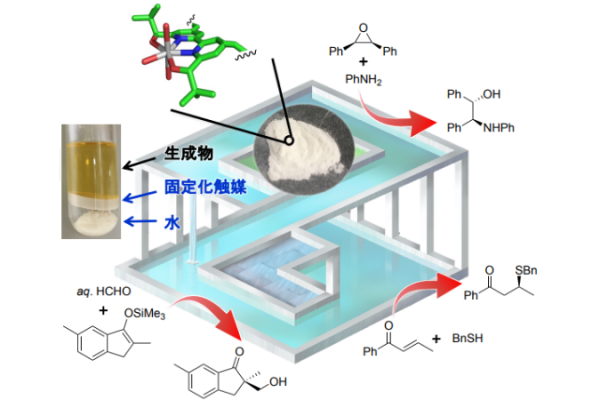



東京大学 大学院理学系研究科 化学専攻 理学部化学科
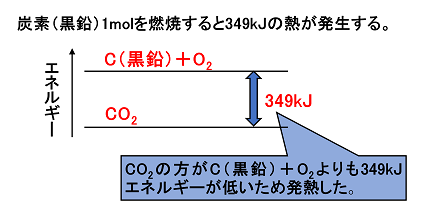



化学変化とエネルギー



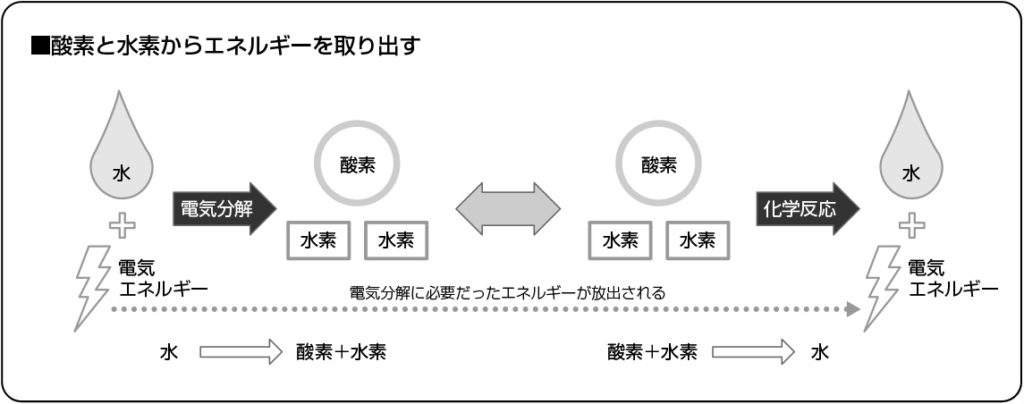
1




熱化学方程式 単体の化学エネルギーを0とする方法 化学がちょっとだけ好きな社労士




高校化学 融解熱 映像授業のtry It トライイット
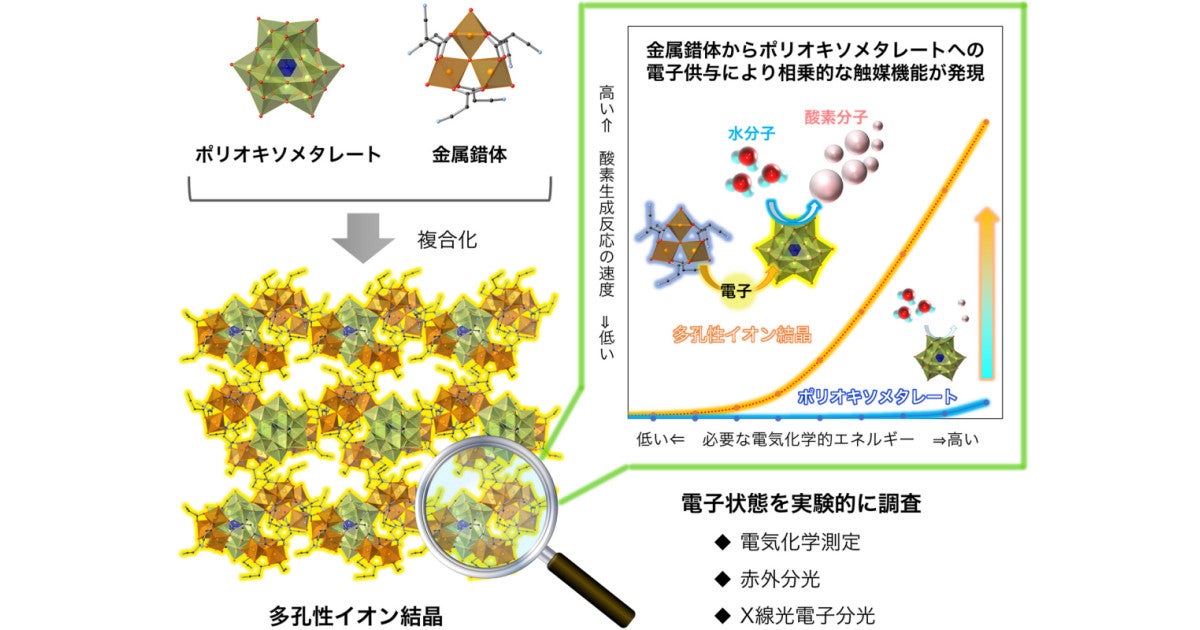



東京大学 水電解における酸素生成反応を促進する結晶性材料の開発に成功 Tech
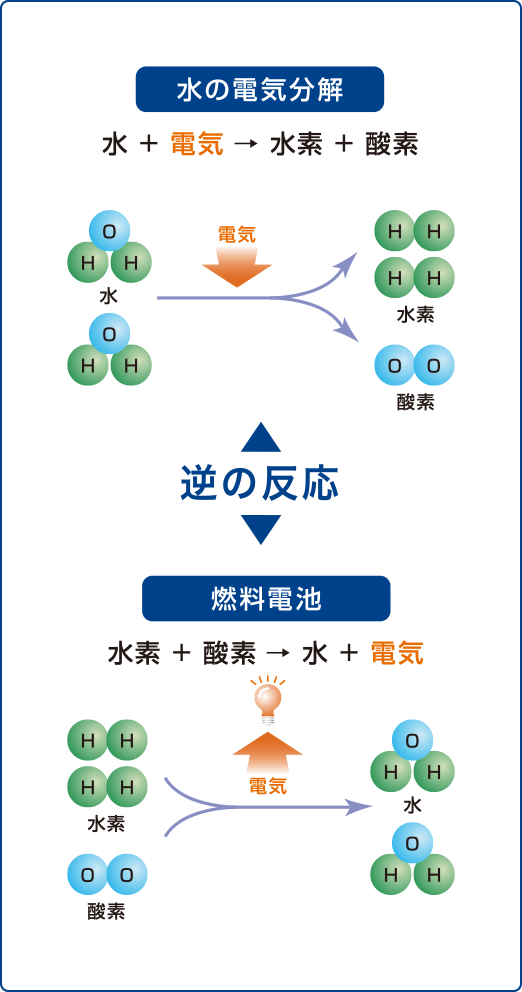



水素の基礎知識 みえ水素ステーション
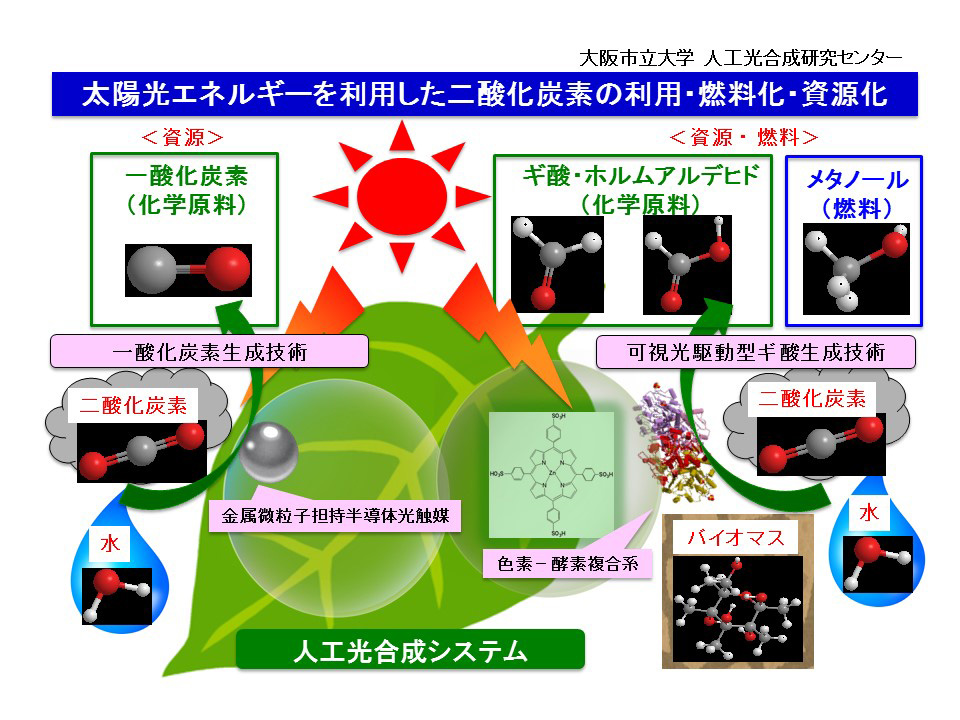



太陽光エネルギーを利用した二酸化炭素の利用 燃料化 資源化




高校化学 蒸発熱と昇華熱 映像授業のtry It トライイット
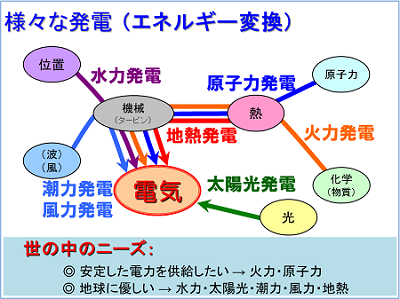



身近な材料で エネルギー を創り出そう みらいぶプラス 河合塾
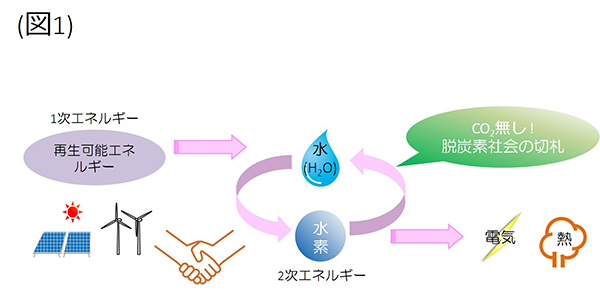



Ynu 横浜国立大学 材料電気化学研究室
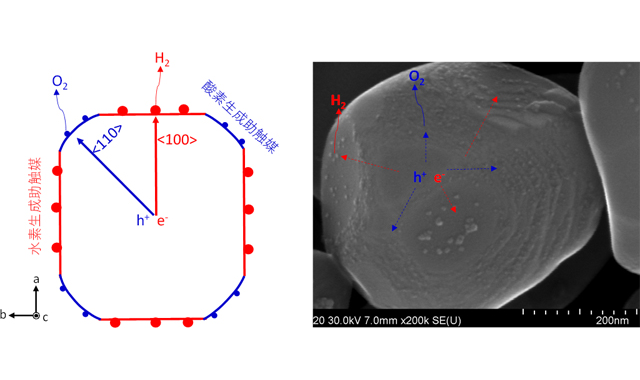



ほぼ100 の量子収率で水を分解する半導体光触媒を開発 太陽光エネルギー変換効率向上に期待 Nedoら Fabcross For エンジニア




水の科学 氷 水 水蒸気 水の三態 水大事典 サントリーのエコ活 サントリー



化学 結合エネルギー 技術情報館 Sekigin 反応熱 すなわち自由エネルー変化と物質の結合エネルギーの関係について概説
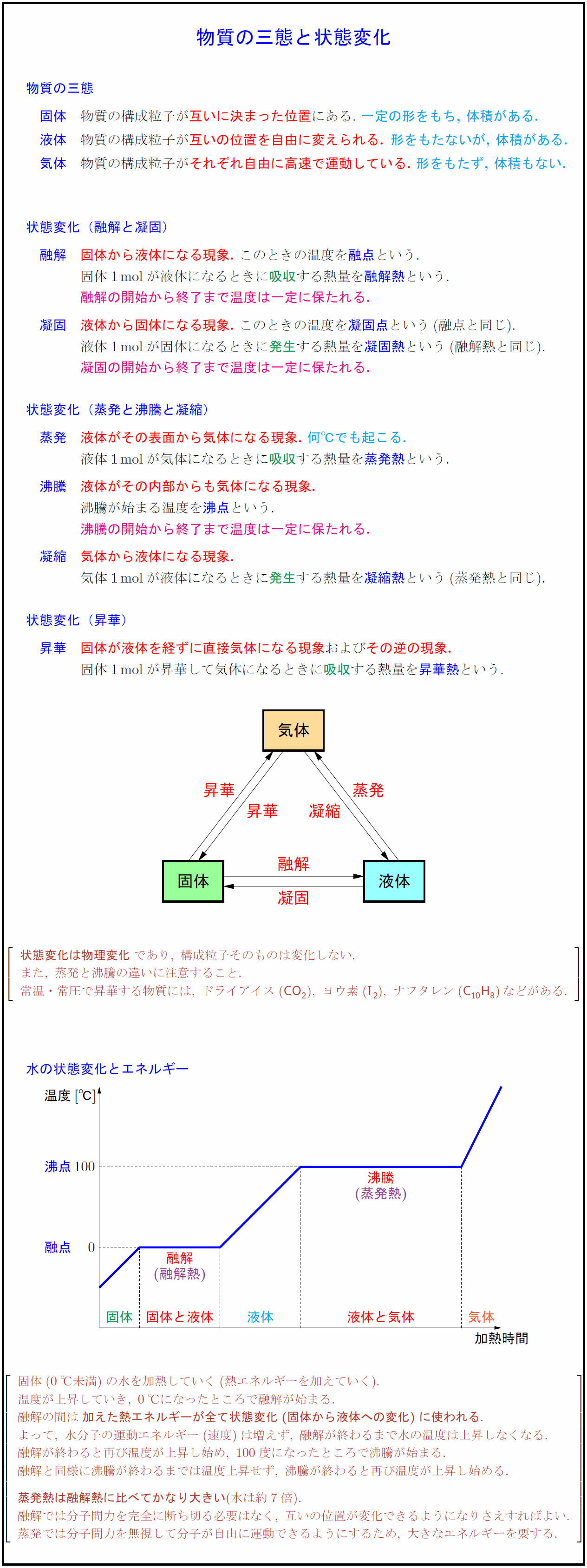



高校理論化学 物質の三態 固体 液体 気体 水の状態変化とエネルギー 受験の月




サイエンス カフェ 水と二酸化炭素が資源になる 太陽光エネルギー利用に向けた化学の挑戦 イベントカレンダー 東京工業大学



0 件のコメント:
コメントを投稿